 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
[单选题]
用KMnO4溶液滴定Fe2+,化学计量点电位处于滴定突跃的( )。
A.中点偏下
B.中点
C.中点偏上
D.随浓度的不同而不同
查看答案
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
A.中点偏下
B.中点
C.中点偏上
D.随浓度的不同而不同
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“用KMnO4溶液滴定Fe2+,化学计量点电位处于滴定突跃的(…”相关的问题
更多“用KMnO4溶液滴定Fe2+,化学计量点电位处于滴定突跃的(…”相关的问题
A.1.01V
B.2.01V
C.1.06V
D.0.98V
计算在1mol·L-1HCl溶液中,用Fe3+滴定Sn2+时化学计量点的电势,并计算滴定至99.9%和100.1%时的电势。说明为什么化学计量点前后,同样改变0.1%,电势的变化不相同。若用电势滴定判断终点,与计算所得化学计量点电势一致吗?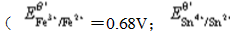
用0.100mol·L-1HCl溶液滴定0.0500mol·L-1甲胺(CH3NH2)和0.0500mol·L-1氨(NH3)的混合溶液。当滴定至化学计量点时,溶液的pH值是多少?[Kb(CH3NH2)=4.2×10-4,Kb(NH3)=1.8×10-5]
用c(CHL)=0.1mol•L-1HCl溶液滴定c(NH3)=0.1mol•L-1氨水溶液化学计量点时溶液的pH值为()。
A.等于7.0;
B.小于7.0;
C.等于8.0;
D.大于7.0