 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
在2 L容积不变的容器中,发生N2(g)+3H2(g) 2NH3(g)的反应。现通入4 mol H2和4 mol N2,10 s 内用H2表示的反应速率为0.12 mol·L-1·s-1,则10 s时容器中N2的物质的量是()
A.1.6 mol
B.2.8 mol
C.3.2 mol
D.3.6 mol
 答案
答案
C、3.2 mol
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
A.1.6 mol
B.2.8 mol
C.3.2 mol
D.3.6 mol
 答案
答案
C、3.2 mol
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“在2 L容积不变的容器中,发生N2(g)+3H2(g) 2N…”相关的问题
更多“在2 L容积不变的容器中,发生N2(g)+3H2(g) 2N…”相关的问题
A.x+y<z
B.平衡向正反应方向移动
C.的转化率增大
D.的体积分数下降
A.1.2mol/(L·min)
B.1.8mol/(L·min)
C.0.6mol/(L·min)
D.0.4mol/(L·min)
可逆反应 达到化学平衡时:
达到化学平衡时:
(1)升高温度,反应标准平衡常数(),其原因是();
(2)在温度不变的条件下压缩气体的体积而增大压力时,I(g)的解离度().其原因是();
(3)恒容条件下充入N2,I2(g)的解离度(),其原因是()。
(4)恒压条件下充入N2,I2(g)的解离度(),其原因是()。
A、n/2
B、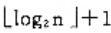
C、log2n
D、n
E、n3+n1+n2
F、1+n2
G、n2+1
H、1
L、n+1
J、n1
K、n2
L、n1+1
A.v(H2)=0.1mol·(L·min)-1
B.v(N2)=0.1mol·(L·min)-1
C.v(N2)=0.2mol·(L·min)-1
D.v(NH3)=0.3mol·(L·min)-1
烟气的脱硫(除SO2)技术和脱硝(除NOx)技术都是环境科学研究的热点。
问题一、选择性催化复原法的脱硝原理为:

①上述反应中每转移3mol电子,生成标准状况下N2的体积为()L。
②已知:2H2(g)+O2(g)=2H2O(g)ΔH=-483.6kJ•mol-1
N2(g)+3H2(g)=2NH3(g)ΔH=-92.4kJ•mol-1
N2(g)+O2(g)=2NO(g)ΔH=-180.5kJ•mol-1
则反应6NO(g)+4NH3(g)=5N2(g)+6H2O(g)的ΔH=()。
问题二、目前,科学家正在研究一种以乙烯作为复原剂的脱硝(NO)原理,其脱硝机理示意图如以下图1,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图2所示。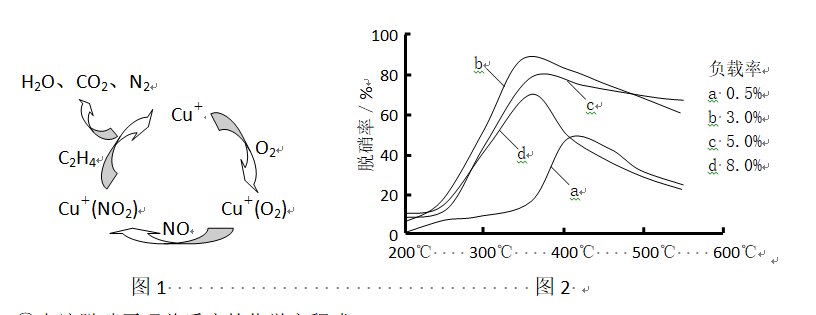
①出该脱硝原理总反应的化学方程式:()。
②为到达最正确脱硝效果,应采取的条件是()。
A.1:3
B.1:2
C.4:5
D.2:3
g)和H2O(l)。过程放热401.727kJ。求
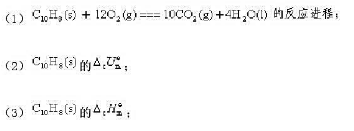
体积为1dm3的抽空密闭容器中放有0.03458molN2O4(g),发生如下分解反应:

50℃时分解反应的平衡总压为130.0kPa.已知25℃时N2O4(g)和NO2(g)的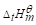
分别为9.16kJ·mol-1和33.18kJ·mol-1.设反应的ΔTGp,m=0.
(1)计算50℃时N2O4(g)的解离度及分解反应的Kθ;
(2)计算100C时反应的Kθ.
A.v(NH3)=0.01 mol·L−1·s−1
B.v(O2)=0.001 mol·L−1·s−1
C.v(NO)=0.001 mol·L−1·s−1
D.v(H2O)=0.045 mol·L−1·s−1