 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
准确移取1.0 mg/mL铜的标准溶液2.50 mL至500 mL容量瓶中,加溶剂稀释至刻度,则稀释后的溶液含铜为5.0g/mL()
 答案
答案
是
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
 答案
答案
是
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“准确移取1.0 mg/mL铜的标准溶液2.50 mL至500…”相关的问题
更多“准确移取1.0 mg/mL铜的标准溶液2.50 mL至500…”相关的问题
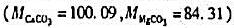
准确量取30.00 mL弱酸HA,加水稀释至100.00 mL,在电池:(—)SHE|HA || SCE()中,以0.100 0 mol·L-1NaOH标准溶液滴定之。25℃时,当弱酸HA被中和一半时,电池电动势为0.524 V,化学计量点时,电池电动势为0.749 V。求:(1)弱酸HA的电离常数Kα值。(2)原弱酸HA溶液的浓度?(已知饱和甘汞电极的电极电位为0.244 V)
A.0.0500mg/mL
B.0.1000mg/mL
C.0.1500mg/mL
D.0.2000mg/mL
用内标法测定试样中镁的含量。用蒸馏水溶解MgCl2以配制标准镁溶液系列。在每一标准溶液和待测溶液中均含有25.0ng/mL的钼。钼溶液用溶解钼酸铵而得。测定时吸取50mL的溶液于铜电极上,溶液蒸发至干后摄谱,测量279.8nm处镁谱线强度和281.6nm处钼谱线强度,得到数据见表8-6。试据此确定试液中镁的浓度。
| 表8-6测定数据 | |||||
| ρMg /(ng/mL) | 相对强度 | ρMg /(ng/mL) | 相对强度 | ||
| 279.8nm | 281.6nm | 279.8nm | 281.6nm | ||
| 1.05 10.5 100.5 | 0.67 3.4 18 | 1.8 1.6 1.5 | 1050 10500 分析试样 | 115 739 2.5 | 1.7 1.9 1.8 |
移取一定量V0(mL)试液,在pH=1的HNO3介质中,用EDTA标准溶液滴定至二甲酚橙由红变黄,耗去V1。再加入六次甲基四胺,调至pH=5,继续以EDTA滴定至终点(总耗去V2)。
(1)滴定Bi3+的酸度过高与过低对结果有何影响,能否以HCl代替HNO3?
(2)滴定Pb2+时加入六次甲基四胺调节pH的机理何在?调节pH是否可以用NaOH或氨水?
(3)加入六次甲基四胺后溶液为何色?终点为何色?
(4)写出计算Bi3+和Pb2+质量浓度(以g/mL表示)的公式。
A.精密要求不高的溶液可以放在量筒配制即可
B.配制准确体积的标准溶液或被测溶液用容量瓶
C.溶量瓶配制样品时可用热水浴中加热
D.移液管能准确地移取一定量的液体
称取0.3511g FeSO4·(NH4)2SO4·6H2O溶于水,加入1:4的H2SO420cm3,定容至500cm3。取体积为V的铁标准溶液置于50cm3容量瓶中,用邻二氮菲显色后加水稀释至刻度,分别测得吸光度列于下表,用表中数据绘制工作曲线。吸取试液5.00cm3,稀释至250cm3,再吸取此稀释液2.00cm3置于50cm3容量瓶中,与绘制工作曲线相同条件下显色后,测得吸光度为0.281,求试液中铁含量p(mg·cm-3)。已知Mr[FeSO4·(NH4)2SO4·6H2O]=392.17,Ar(Fe)=55.85。
| 铁标准溶液V 0.0 0.20 0.40 0.60 0.80 1.0 |
| 吸光度A 0 0.085 0.165 0.248 0.318 0.398 |