 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
298K时,已知(NaCl)=1.086×10-2S·m2·mol-1,-2(NaOH)=2.172×10-2S·m2·mol-1和(NH4Cl)=1.298×10-2S·m2·mol-1;N
298K时,已知 (NaCl)=1.086×10-2S·m2·mol-1,-2(NaOH)=2.172×10-2S·m2·mol-1和
(NaCl)=1.086×10-2S·m2·mol-1,-2(NaOH)=2.172×10-2S·m2·mol-1和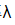 (NH4Cl)=1.298×10-2S·m2·mol-1;NH3·H2O在浓度为0.1mol·dm-3时的摩尔电导率Am=3.09×10-4S·m2·mol-1,浓度为0.01mol·dm-3时的摩尔电导率Am=9.62×10-4S·m2·mol-1。试根据上述数据求NH3·H2O的两种不同浓度溶液的解离度和解离常数。
(NH4Cl)=1.298×10-2S·m2·mol-1;NH3·H2O在浓度为0.1mol·dm-3时的摩尔电导率Am=3.09×10-4S·m2·mol-1,浓度为0.01mol·dm-3时的摩尔电导率Am=9.62×10-4S·m2·mol-1。试根据上述数据求NH3·H2O的两种不同浓度溶液的解离度和解离常数。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案


 更多“298K时,已知(NaCl)=1.086×10-2S·m2·…”相关的问题
更多“298K时,已知(NaCl)=1.086×10-2S·m2·…”相关的问题
 (AgCl,s)=-109.79kJ·mol-1,
(AgCl,s)=-109.79kJ·mol-1,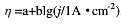 ,且Tafel常数a=0.73V,b=0.11V,
,且Tafel常数a=0.73V,b=0.11V,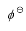 =1.36V,请计算实际的分解电压。
=1.36V,请计算实际的分解电压。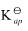 =a+a-=5.77×10-5(计算中可作合理的近似)。
=a+a-=5.77×10-5(计算中可作合理的近似)。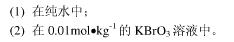
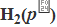 |Pt
|Pt


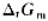 64¿O遇热分解:
64¿O遇热分解: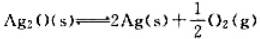
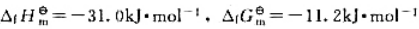 , 试估算Ag2O的最低分解温度及298K时该系统中p(O2)。
, 试估算Ag2O的最低分解温度及298K时该系统中p(O2)。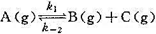 ,已知在298 K时,k1=0.21s-1,k-2=5×10-9Pa-1·s-1,当温度由298 K升到310 K时,k和k-2的值均增加1倍,试求:
,已知在298 K时,k1=0.21s-1,k-2=5×10-9Pa-1·s-1,当温度由298 K升到310 K时,k和k-2的值均增加1倍,试求: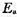 ;
;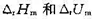 ;
;
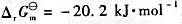 。试计算:
。试计算: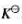 ;
;















