 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
在pH=10.0的氨性缓冲溶液中,以0.020mol/L EDTA滴定相同浓度的Zn2+,已知lgKZnY=16.5,lgαY(H)=0.5,lgαZn(NH3)=5.0,lgαZn(OH)=2.4,则化学计量点时pZn'值为( )
A.6.5
B.8.0
C.11.5
D.10.0
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
A.6.5
B.8.0
C.11.5
D.10.0
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“在pH=10.0的氨性缓冲溶液中,以0.020mol/L E…”相关的问题
更多“在pH=10.0的氨性缓冲溶液中,以0.020mol/L E…”相关的问题
今有下列两种铬黑类的指示剂:铬黑A(EBA)的pKa=6.2,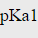 =13.0,lgKMg-EBA=7.2;铬黑T(EBT)的
=13.0,lgKMg-EBA=7.2;铬黑T(EBT)的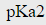 =6.3,
=6.3,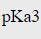 =11.6,lgKMg-EBT=7.0。若在pH=10.0的氨性缓冲溶液中,以2.0×10-3mol·L-1EDTA滴定同浓度的Mg2+。问选用哪一种指示剂更灵敏(即△pM最小)?(lgKMgY=8.7;pH=10.0时,lgαY(H)=0.45)
=11.6,lgKMg-EBT=7.0。若在pH=10.0的氨性缓冲溶液中,以2.0×10-3mol·L-1EDTA滴定同浓度的Mg2+。问选用哪一种指示剂更灵敏(即△pM最小)?(lgKMgY=8.7;pH=10.0时,lgαY(H)=0.45)
在pH=10.0的氨性溶液中,以铬黑T(EBT)为指示剂,用0.0200mol·L-1EDTA滴定同浓度的Zn2+,计算终点误差。(lgKZnY=16.50,lgαY(H)=0.45,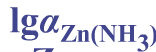 =5.0,lgαZn(OH)=2.4,pZnep(EBT)=12.2)
=5.0,lgαZn(OH)=2.4,pZnep(EBT)=12.2)
在pH=10.0的NH3-NH4Cl总浓度为0.25mol·L-1的缓冲溶液中,以0.0100mol·L-1EDTA滴定同浓度的Zn2+。计算化学计量点时总的锌离子浓度pZn'ep和游离的锌离子浓度pZnsp。若以铬黑T(EBT)为指示剂,则终点时的总的锌离子浓度pZn'ep为多少?(lgKZnY=16.5;pH=10.0时,lgαY(H)=0.45,pZnep(EBT)=12.2;Zn2+-NH3络合物的lgβ1~lgβ4分别为2.4、4.8、7.3、9.5)
在pH=10的氨性缓冲溶液中,用EDTA滴定同浓度的Zn2+到化学计量点时,下列关系哪一种是正确的?( )

浓度为0.04985mol/L的EDTA标准溶液24.5ml,试计算葡萄糖酸钙的含量。(分子量为448.4)
已知M(NH3)42+的 为2.0、5.0、7.0、10.0; M(OH)42+的
为2.0、5.0、7.0、10.0; M(OH)42+的 为4.0、8.0、 14.0、15.0.在浓度为0.10 mol.L-1的M2+溶液中,滴加氨水至溶液中的游离NH3度为0.010mol.L-1, pH=9.0.试问溶液中的主要存在形式是哪一种? 浓度为多大?若将M2+溶液用NaOH和氨水调节至pH=13.0且游离NH3浓度为0.010mol.L-1则上述溶液中的主要存在形式是什么?浓度又为多少?
为4.0、8.0、 14.0、15.0.在浓度为0.10 mol.L-1的M2+溶液中,滴加氨水至溶液中的游离NH3度为0.010mol.L-1, pH=9.0.试问溶液中的主要存在形式是哪一种? 浓度为多大?若将M2+溶液用NaOH和氨水调节至pH=13.0且游离NH3浓度为0.010mol.L-1则上述溶液中的主要存在形式是什么?浓度又为多少?
欲配制pH=10.0缓冲溶液应选用的一对物质是():
A.HAc(Ka=1.8×10-5)~NaAc
B.HAc~NH4Ac
C.NH3·H2O (Kb=1.8×10-5)~NH4Cl
D.KH2PO4-Na2HPO4