 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
称取未知酸HA(M=82.00)试样1.600g,溶解稀释至60.00ml。用0.2500mol/LNaOH作电位滴定。已知中和一半时,溶液pH=5.00;中和到计量点时,pH=9.00,计算HA的质量分数。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“称取未知酸HA(M=82.00)试样1.600g,溶解稀释至…”相关的问题
更多“称取未知酸HA(M=82.00)试样1.600g,溶解稀释至…”相关的问题
已知试样中含有Na2CO3,NaHCO3和惰性杂质,称取样品0.527g,用0.109mol/L-1HCl滴定,需15.7mL,到达酚酞终点。当到达甲基橙终点时,所用滴定剂总体积为43.8mL,问混合物中Na2CO3,NaHCO3的质量分数。M(Na2CO3)=105.99g·mol-1,M(NaHCO3)=84.01g·mol-1
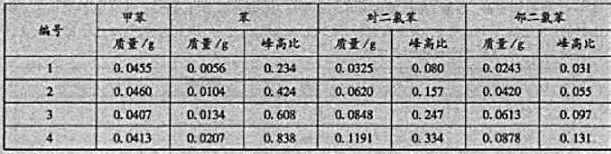
在分析未知试样时,称取氯苯试样5.119g,加入内标0.0421g,测得色谱图,从图上量取各色谱峰的峰高.并求得峰高比如下,求试样中各杂质的质量分数:苯与甲苯峰高之比值=0.341,对二氧苯与甲苯峰高之比值=0.298,邻二氧苯与甲苯峰高之比值二0.042.
称取含惰性杂质的混合碱(Na2CO3+NaOH或Na2CO3+NaHCO3)试样0.600g,溶于水后,用0.5000mol·L-1HCl滴至酚酞褪色,用去15.00mL。然后加入甲基橙指示剂,用HCl继续滴至橙色出现, 又用去2.500mL。问试样由何种碱组成?各组分的质量分数为多少?已知M(Na2CO3)=106.00g·mol-1;M(NaOH)=40.00g·mol-1;M(NaHCO3)=84.01g·mol-1.
称取含惰性杂质的混合碱(Na2CO3和NaOH或NaHCO3和Na2CO3的混合物)试样1.00g。溶于水后,用酚酞作指承剂,用0.2500mol·L-1HCl滴至终点,消耗HCl 20.40mL然后加入甲基橙指示剂,用HCl继续滴至橙色出现,又用去28.46mL试判断试样由何种碱组成?各组分的质量分数是多少?已知M(Na2CO3)=106.00g·mol-1;M(NaHCO3)=84.01g·mol-1。
准确量取30.00ml弱酸,加水稀释至100ml。以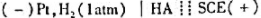 为测定电池,以0.1000mol/LNaOH溶液滴定弱酸HA。当酸被中和一半时,电池电动势为0.524V;化学计量点时,电池电动势为0.749V。φSCE=0.242V。计算:
为测定电池,以0.1000mol/LNaOH溶液滴定弱酸HA。当酸被中和一半时,电池电动势为0.524V;化学计量点时,电池电动势为0.749V。φSCE=0.242V。计算:
(1)弱酸HA的Ka。
(2)原弱酸HA的浓度。