 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
在25℃下将铁放入Fe2+活度为1的溶液(pH=3)中,已知Fe2+还原为Fe的交换电流密度为2×10-5A·m-2,氢在该溶液中析
在25℃下将铁放入Fe2+活度为1的溶液(pH=3)中,已知Fe2+还原为Fe的交换电流密度为2×10-5A·m-2,氢在该溶液中析出的交换电流密度为1.6×10-3A·m-2;Fe氧化过程和氢离子还原过程的b值分别为0.06和0.12V,试求腐蚀电位和腐蚀电流密度。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
在25℃下将铁放入Fe2+活度为1的溶液(pH=3)中,已知Fe2+还原为Fe的交换电流密度为2×10-5A·m-2,氢在该溶液中析出的交换电流密度为1.6×10-3A·m-2;Fe氧化过程和氢离子还原过程的b值分别为0.06和0.12V,试求腐蚀电位和腐蚀电流密度。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“在25℃下将铁放入Fe2+活度为1的溶液(pH=3)中,已知…”相关的问题
更多“在25℃下将铁放入Fe2+活度为1的溶液(pH=3)中,已知…”相关的问题
称取铁样0.2801g,溶解后,将溶液中的Fe3+还原为Fe2+,然后用0.02000mol·L-1
K2Cr2O7标准溶液滴定,用去25.60mL,试计算:(1)K2Cr2O7标准溶液对Fe及(Fe2O3)滴定度;(2)试样中w(Fe)和w(Fe2O3).
25℃下测得CS2(B)和丙酮(C)形成的混合溶液在不同浓度时CS2(B)的分压为

已知CS2的亨利系数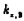 =267.98kPa,请分别用拉乌尔定律计算CS2的活度与活度因子,并讨论结果说明了什么.
=267.98kPa,请分别用拉乌尔定律计算CS2的活度与活度因子,并讨论结果说明了什么.
A.保存FeCl2溶液常常加一些铁粉,其目的是抑制Fe2+水解
B.25℃,pH=0的溶液中Al3+、NH、NO、Fe2+可以大量共存
C.制备AlCl3、FeCl3均可采用将溶液直接蒸干的方法
D.硫酸亚铁溶液中加入过氧化氢溶液:2Fe2++H2O2+2H+===2Fe3++2H2O
电池: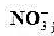 选择性电极[
选择性电极[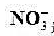 (a=5.0X10-3mo1/L)]ISCE的电动势为0.386V。计算:
(a=5.0X10-3mo1/L)]ISCE的电动势为0.386V。计算:
(1)用未知活度的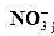 溶液代替已知活度的
溶液代替已知活度的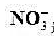 溶液,测得其电动势为0.429v,未知溶液中
溶液,测得其电动势为0.429v,未知溶液中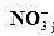 活度为多少?
活度为多少?
(2)若液接电位产生的误差为士0.002V,活度在什么范围内变化?
A.滤渣1的主要成分只有SiO2,滤渣2可用于制备铁红
B.在氧化中,0.5 mol NaClO3最多能氧化4 mol Fe2+
C.在酸浸中发生的反应为Co3++Fe2+===Co2++Fe3+
D.用稀硝酸和AgNO3溶液可检验CoC2O4是否洗涤干净
以黄铁矿为原料制硫酸产生的废渣中含Fe2O3、SiO2、Al2O3、CaO、MgO等。现以此废渣制备铁红(Fe2O3)的过程如下。此浓度时,部分阳离子以氢氧化物形式沉淀时溶液的pH由见右表。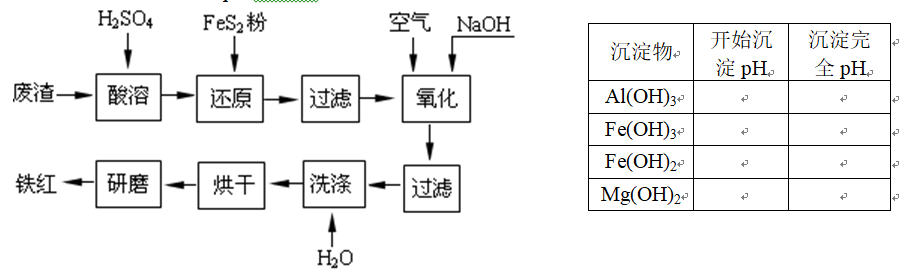 问题一、酸溶过程中Fe2O3与稀硫酸反应的化学方程式是()。
问题一、酸溶过程中Fe2O3与稀硫酸反应的化学方程式是()。
问题二、复原过程中加入FeS2是将溶液中的Fe3+复原为Fe2+,而本身被氧化为SO42-,写出有关的离子方程式:()。
问题三、氧化过程中通入空气和加入NaOH是为了将溶液中的铁元素充分转化为沉淀而析出,写出有关的离子方程式:()。
问题四、为了确保铁红的质量,氧化过程需要调节溶液pH的范围为()≤pH<()。
问题五、假设NaOH加入过量,所的铁红产品中有其它杂质,但可能无Al2O3,其原因是(用离子方程式表示):() 。