 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
离子膜电解工艺中,为了降低氯气中的含氧量,采用盐酸添加系统向阴极液中加入适量的盐酸。此题为判断题(对,错)。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“离子膜电解工艺中,为了降低氯气中的含氧量,采用盐酸添加系统向…”相关的问题
更多“离子膜电解工艺中,为了降低氯气中的含氧量,采用盐酸添加系统向…”相关的问题
A.钠与水反应:Na +2H2O=Na+ + 2OH– + H2↑
B.电解饱和食盐水获取烧碱和氯气(条件通电):2Cl– + 2H2O === H2↑+Cl2↑+2OH–
C.向氢氧化钡溶液中加入稀硫酸:Ba2+ + OH– + H+ + SO42- === BaSO4↓+H2O
D.向碳酸氢铵溶液中加入足量石灰水:Ca2+ + HCO3- + OH– === CaCO3↓+H2O
A.钠与水反应:Na+2H2O===Na++2OH-+H2↑
B.电解饱和食盐水获取烧碱和氯气:2Cl-+2H2Oeq \o(=====,\s\up7(通电))H2↑+Cl2↑+2OH-
C.向氢氧化钡溶液中加入稀硫酸:Ba2++OH-+H++SOeq \o\al(2-,4)===BaSO4↓+H2O
D.向碳酸氢铵溶液中加入足量石灰水:Ca2++HCOeq \o\al(-,3)+OH-===CaCO3↓+H2O
工业上以锂辉石(Li2O·A12O3·4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下: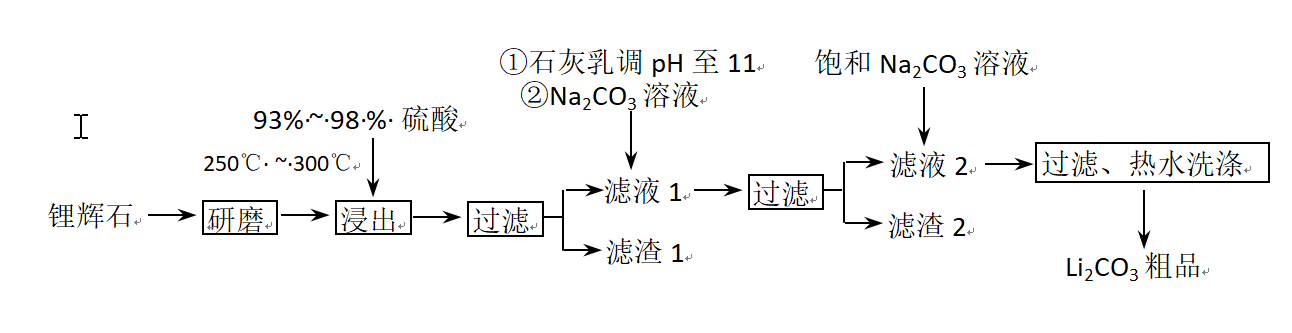 已知:①
已知:①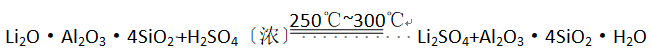 ②某些物质的溶解度(S)如下表所示
②某些物质的溶解度(S)如下表所示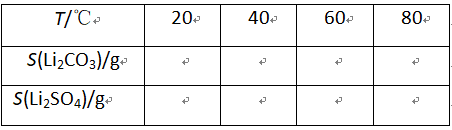
问题一、从滤渣1中别离出Al2O3的部分流程如以下图所示,括号表示加入的试剂,方框表示所得到的物质。则步骤Ⅱ中反应的离子方程式是()。
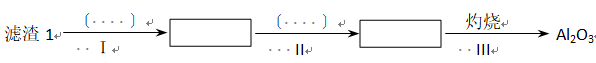
问题二、已知滤渣2的主要成分有Mg(OH)2和CaCO3向滤液1中加入石灰乳的作用是(运用化学平衡原理简述)()
问题三、向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是()
问题四、工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下()
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解
b.电解后向LiOH溶液中加入过量NH4HCO3溶液,过滤、烘干得高纯Li2CO3
①a中,阳极的电极反应式是()。
②b中,生成Li2CO3反应的化学方程式是()。
A.食盐溶液可以导电,是因为溶液中有自由移动的钠离子和氯离子
B.电解熔融氯化钠生成钠和氯气,说明氯化钠是由钠原子和氯分子构成的
C.盐酸、稀硫酸具有相似的化学性质,是因为它们的溶液中都含有氢离子
D.无色酚酞试液滴入某稀溶液中显红色,说明该溶液中可能含有氢氧根离子
A.预先危险分析(PHA)
B.危险和可操作性分析(HAZOP)
C.故障类型和影响分析(FMEA)
D.事件树分析(ETA)
芒硝化学式为Na2SO4·10H2O,无色晶体,易溶于水,是一种分布很广泛的硫酸盐矿物。用如图所示装置电解硫酸钠溶液,模拟工业上离子交换膜法制烧碱的方法。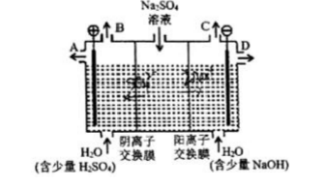 (1)该电解槽的阴极反应式为()。
(1)该电解槽的阴极反应式为()。
(2)电解时,通过阴离子交换膜的离子数()通过阳离子交换膜的离子数。(填大于、小于或等于)。
(3)制得的氢氧化钠溶液从出口()(填写“A”、“B”、“C”、“D”)导出。
(4)①若将制得的氧气、氢氧化钠溶液与天然气组合为甲烷燃料电池,则电池负极的电极反应式为()。
②若将该电池连接两惰性电极,用于电解800mLlmol/L的AgNO3溶液,当原电池中消耗CH4的体积在标况下为0.224L时,电解池中阴极将得到()g的单质,电解池中H+的浓度为()(假设溶液体积不变)。
随着工业的迅速发展,产生的废水对水体的污染也日趋严重。通过控制溶液的pH对工业废水中的金属离子进行别离是实际工作中经常使用的方法。下表是常温下金属氢氧化物的Ksp(沉淀溶解平衡常数)和金属离子在某浓度下开始沉淀所需的pH(表中浓度为相应pH时溶液中有关金属离子产生沉淀的最小浓度;当溶液中金属离子浓度小于10-5mol•L-1时通常认为该离子沉淀完全)。 问题一、某厂排出的废水中含有Cu2+和Fe3+,测得其浓度均小于0.1mol•L-l。为除去其中的Fe3+,回收铜,需控制的pH范围是()。
问题一、某厂排出的废水中含有Cu2+和Fe3+,测得其浓度均小于0.1mol•L-l。为除去其中的Fe3+,回收铜,需控制的pH范围是()。
问题二、为了处理含有Cr2O72-酸性溶液的工业废水,采用如下方法:向废水中加人适量NaCl,以Fe为电极进行电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成排出,从而使废水中铬含量低于排放标准
①Cr2O72-转变为Cr3+的离子方程式为()。
②pH对废水中Cr2072-去除率的影响如右图。你认为电解过程中溶液的pH取值在()范围内对降低废水中的铬含量最有利,请说明理由:()。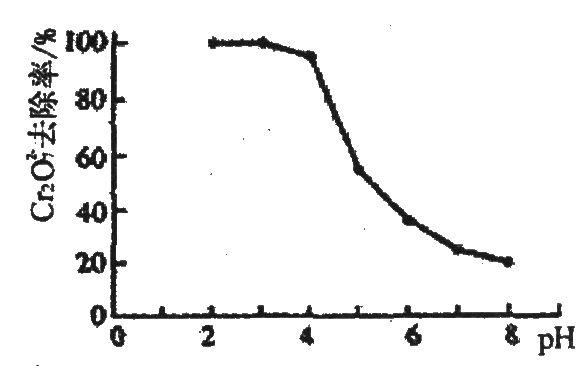
问题三、沉淀转化在生产中也有重要应用。例如,用Na2C03溶液可以将锅炉水垢中的CaS04转化为较疏松而易清除的CaC03,该沉淀转化到达平衡时,其平衡常数K=()。(已知Ksp(CaS04)=9.1x10-6,Ksp(CaC03)=2.8x10-9)