 更多“计算下列原电池的电动势,写出相应的电池反应.”相关的问题
更多“计算下列原电池的电动势,写出相应的电池反应.”相关的问题
将电对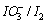 和
和 电对的电势-pH图画在同一直角坐标系中。指出体系中涉及的歧化反应和逆歧化反应发生的具体pH范围。若在298K,pH=11时将所发生的反应以原电池方式完成,试计算原电池的电动势E和电池反应的
电对的电势-pH图画在同一直角坐标系中。指出体系中涉及的歧化反应和逆歧化反应发生的具体pH范围。若在298K,pH=11时将所发生的反应以原电池方式完成,试计算原电池的电动势E和电池反应的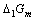 。
。
A.电对Fe3+/Fe2+做正极
B.反应Fe+2Fe3+=3Fe2+的平衡常数大约为8×1040
C.电池组成式为(-)Fe|Fe2+(c1)||Fe2+(c2),Fe3+(c3)|Pt()
D.电池的标准电动势为0.331V
下列电池的电动势为0.460V。计算反应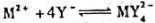 生成的配合物
生成的配合物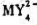 的稳定常数
的稳定常数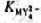 (已知
(已知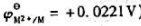 )。
)。
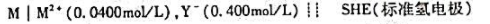
测得下列电池的电动势为0.873V(25℃)
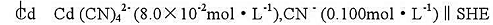
试计算Cd(CN)42-的稳定常数.
25℃时,下列电池的电动势为0.518V(忽略液接电位):
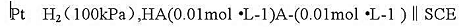
计算弱酸HA的Ka值.
用下列电池按直接电位法测定草酸根离子浓度。
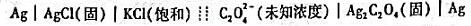
(1)推导出pC2O4与电池电动势之间的关系式
(2)若将一未知浓度的草酸钠溶液置入此电池,在25℃时测得电池电动势为0.402V,Ag-AgCl电极为负极,计算未知溶液的pC2O4。(已知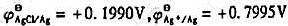 )
)
计算原电池(一)Cu|Cu2+(1.0 mol·kg-1)||Ag+(1.0 mol·kg-1)|Ag()在下述情况下电动势改变值:(1)Cu2+浓度降到1.0X10-3mol·kg-1(2)加入足量的CI-使AgCl沉淀,设CI-浓度为1.561 mol·kg-1
25℃时,实验测得以下三个电池的电动势如下:
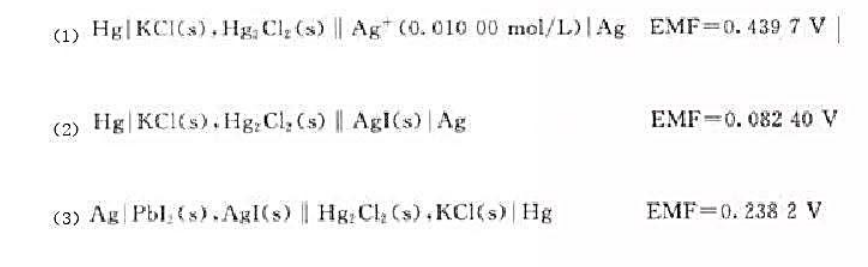
请用实验数据,计算AgI和PbI2的溶度积。已知饱和甘汞电极的电极电位为0.2415V。
电池: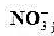 选择性电极[
选择性电极[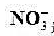 (a=5.0X10-3mo1/L)]ISCE的电动势为0.386V。计算:
(a=5.0X10-3mo1/L)]ISCE的电动势为0.386V。计算:
(1)用未知活度的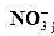 溶液代替已知活度的
溶液代替已知活度的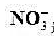 溶液,测得其电动势为0.429v,未知溶液中
溶液,测得其电动势为0.429v,未知溶液中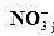 活度为多少?
活度为多少?
(2)若液接电位产生的误差为士0.002V,活度在什么范围内变化?


 如果结果不匹配,请
如果结果不匹配,请 
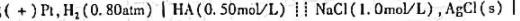
 ,其电动势为0.568V,计算HA的离解常数。
,其电动势为0.568V,计算HA的离解常数。
















