 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
[单选题]
用0.1000mol/LNaOH滴定下列酸能产生两个滴定突跃的是()。
A.丁二酸(Ka1=6.21×10-5,Ka2=2.31×106)
B.亚磷酸(Ka1=3.0×10-2,Ka2=1.62×10-7)
C.酒石酸(Ka1=9.2×10-4,Ka2=4.31×10-5)
D.马来酸(Ka1=1.23×10-2,Ka2=4.66×10-7)
查看答案
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
A.丁二酸(Ka1=6.21×10-5,Ka2=2.31×106)
B.亚磷酸(Ka1=3.0×10-2,Ka2=1.62×10-7)
C.酒石酸(Ka1=9.2×10-4,Ka2=4.31×10-5)
D.马来酸(Ka1=1.23×10-2,Ka2=4.66×10-7)
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“用0.1000mol/LNaOH滴定下列酸能产生两个滴定突跃…”相关的问题
更多“用0.1000mol/LNaOH滴定下列酸能产生两个滴定突跃…”相关的问题
准确量取30.00ml弱酸,加水稀释至100ml。以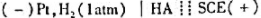 为测定电池,以0.1000mol/LNaOH溶液滴定弱酸HA。当酸被中和一半时,电池电动势为0.524V;化学计量点时,电池电动势为0.749V。φSCE=0.242V。计算:
为测定电池,以0.1000mol/LNaOH溶液滴定弱酸HA。当酸被中和一半时,电池电动势为0.524V;化学计量点时,电池电动势为0.749V。φSCE=0.242V。计算:
(1)弱酸HA的Ka。
(2)原弱酸HA的浓度。
用C(NaOH)0.1000mol/L的NaOH溶液滴定C(H2SO4)0.1000mol/LH2SO4溶液20.00ml,以甲基红为指示剂,问终点时需要消耗NaOH溶液多少毫升?
A.8.74~10.70
B.6.74~9.70
C.6.74~10.70
D.5.74~9.70
A.3.30~10.70
B.4.30~9.70
C.5.30~8.70
D.5.30~9.70
A.甲基橙
B.甲基红
C.溴酚蓝
D.中性红
柠檬酸为三元弱酸,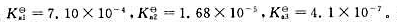 用NaOH标准溶液滴定0.1000mol·L-1柠檬酸溶液时,产生的滴定突跃为()。
用NaOH标准溶液滴定0.1000mol·L-1柠檬酸溶液时,产生的滴定突跃为()。
A、1个
B、2个
C、3个
D、无突跃
在酸性条件下,用0.1000mol/L的K2Cr2O7溶液滴定0.1000m0/L20.00mFe2+,已知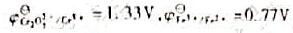 ,合适的指示剂为()。
,合适的指示剂为()。
A.亚甲蓝
B.邻二氮菲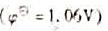
C.二苯胺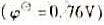
D.变胺蓝
A.NaOH
B.NaOH+Na2CO3
C.NaHCO3+Na2CO3
D.Na2CO3
E.NaHCO3