 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
已知下列元素在周期表中的位置,写出它们的外层电子构型和元素符号:(1)第四周期第Ⅳ族__;(2)第五周期第Ⅵ族__
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“已知下列元素在周期表中的位置,写出它们的外层电子构型和元素符…”相关的问题
更多“已知下列元素在周期表中的位置,写出它们的外层电子构型和元素符…”相关的问题
(2)写出A原子的电子排布式和元素符号();()。
(3)指出元素A在周期表中的位置()。
(4))指出元素A的最高化合价()。
(5)A的氢化物分子中共价键的类型可能有()。
①s-pσ键②p-pσ键③s-sσ键④p-pΠ键
(6)写出与A同周期未成对电子数最多的元素原子的价层电子排布式()。
分别写出下列元素基态原子的电子分布式,并分别指出各元素在周期表中的位置。
9F10Ne25Mn29Cu24Cr55Cs71Lu
氮、磷、砷(As)、锑(Sb)、铋(B)、镆(Mc)为元素周期表中原子序数依次增大的同族元素。回答下列问题:
1)砷在元素周期表中的位置是()。288115Mc的中子数为()。
已知:P(s,白磷)=P(s,黑磷)ΔH=-39.3kJ/mol,P(s,白磷)=P(s,红磷)ΔH=-17.6kJ/mol,由此推知,其中最稳定的磷单质是()。
2)氮和磷氢化物性质的比较:热稳定性:PH3()(填>或<)NH3,沸点:P2H4()N2H4,判断依据是()。
3)PH3与卤化氢和N2H4与卤化氢的反应相似,产物的结构和性质也相似。下列对PH3与HI反应产物的推断正确的是()(填序号)。
a.含离子键b.能与水发生水解反应c.不能与NaOH反应
4)SbCl3能发生较强烈的水解,生成难溶的SbOCl,写出该反应的化学方程式(),因此,配制SbCl3溶液应()。
A.已知原子的核电荷数,可以推知该原子的周期序数
B.原子的电子层数等于该原子的周期序数,前20号元素中,阳离子的电子层数等于对应原子的周期序数减去1,阴离子的电子层数等于对应原子的周期序数
C.知道原子的周期序数,就能确定该元素在周期表中的位置
D.知道原子的周期序数,还不能确定该元素在周期表中的位置
A.原子半径:W>Z>Y>X
B.气态氢化物的稳定性:Y>Z
C.最高价氧化物对应水化物的酸性:W>Z
D.四种元素的单质中,Z的熔、沸点最高
(1)A的元素符号为(),其在元素周期表的位置:第()周期,第()族。
(2)元素A、B形成的最简单的气态氢化物稳定性较强的是()(填化学式),元素C和D可形成化合物DC2,其电子式为()。
(3)F的单质加入到D的最高价氧化物对应水化物的溶液中,发生反应的离子方程式为();上述反应的气体产物和C元素的单质设计成的燃料电池已用于航天飞机。试写出以30%KOH溶液为电解质溶液的这种电池在工作时负极的电极反应式为()。
(4)工业制取E的化学反应方程式为()。
A.在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素
B.在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀材料的元素
C.在金属元素区域可以寻找制备新型农药材料的元素
D.元素周期表中位置越靠近的元素性质越相近
下表是元素周期表中的一部分,回答下列问题: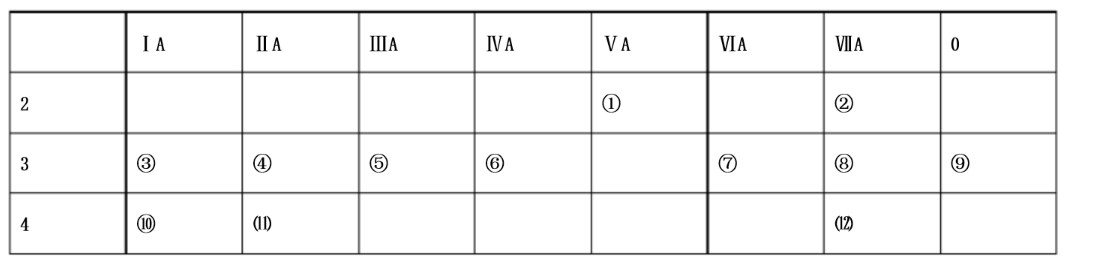 (1)写出下列元素名称①(),⑤(),⑨(),⑾()。
(1)写出下列元素名称①(),⑤(),⑨(),⑾()。
(2)在这些元素中,金属性最强的元素是()﹔除稀有气体元素以外的元素中原子半径最大的是(),原子半径最小的是()。其氢化物最稳定的是()。(填写元素符号)
(3)元素②和③形成的离子的电子层结构()(填“相同”或“不相同”),两者形成的化合物是否是离子化合物()(填“是”或“否”),该化合物的电子式为()。
(4)元素⑧的最高价氧化物对应的水化物化学式为:()名称为()。
(5)在这些元素的最高价氧化物对应的水化物中,属于两性氢氧化物的是()(填写化学式),写出其和盐酸反应的化学方程式()。
从铝+矿(主要成分是Al2O3,含RO2、Fe2O3等杂质)中提取Al2O3的一种工艺流程如图13所示: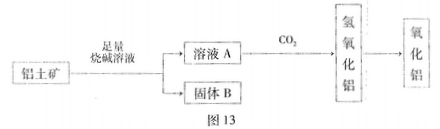
问题一、元素R位于周期表中的第三周期,其最高正化合价和负化合价的绝对值相等。RO2的用途有(写出1条即可)()。
问题二、铝土矿加入足量烧碱溶液后主要反应的离子方程式为
①()。
②()。
问题三、工业上通过电解氧化铝和冰晶石的熔融液来冶炼金属铝。已知电极材料为惰性材料,阳极反应式为()。
问题四、氧化铝与焦炭的混合物在氮气中高温加热反应,制得新型非金属材料AIN与一种中学常见气体X。已知每转移3mole-,有1.5mol化合物X生成,此反应的化学方程式()。
随原子序数递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如图所示。
 根据判断出的元素回答问题:(1)z在周期表中的位置是()。
根据判断出的元素回答问题:(1)z在周期表中的位置是()。
(2)写出x和d组成的一种四原子共价化合物的电子式()。
(3)y、g、h的最高价氧化物对应水化物的酸性最强的是()(填化学式)。
(4)写出f的最高价氧化物与e的最高价氧化物对应的水化物反应的离子方程式()。
(5)己知e和g的最高价氧化物对应的水化物的稀溶液反应生成1mol水时所放出的热量为Qk。请写出该反应的中和热的热化学方程式()。
(6)用y元素的单质与f元素的单质可以制成电极浸入由x、d、e三种元素组成的化合物的溶液中构成电池负极反应式为()。