 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
列表写出下列配合物的名称、中心离子及其氧化态、配离子的电荷。 Na3[Ag(S2O3)2] [Cu(CN)4]3- [CoCl3(NH3)3
列表写出下列配合物的名称、中心离子及其氧化态、配离子的电荷。
Na3[Ag(S2O3)2] [Cu(CN)4]3-[CoCl3(NH3)3] [CrCI(NH3)5]2+
Na2[SiF6] [Co(C2O4)3]3-[PtCl4(NH3)2] [Zn(NH3)4](OH)2
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
列表写出下列配合物的名称、中心离子及其氧化态、配离子的电荷。
Na3[Ag(S2O3)2] [Cu(CN)4]3-[CoCl3(NH3)3] [CrCI(NH3)5]2+
Na2[SiF6] [Co(C2O4)3]3-[PtCl4(NH3)2] [Zn(NH3)4](OH)2
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“列表写出下列配合物的名称、中心离子及其氧化态、配离子的电荷。…”相关的问题
更多“列表写出下列配合物的名称、中心离子及其氧化态、配离子的电荷。…”相关的问题
已知下列配合物的分裂能(△。)和中心离子的电子成对能(P),写出各中心离子的d电子排布式,并估算它们的磁矩各为多少。指出这些配合物中何者为高自旋型,何者为低自旋型?
配离子 (1)[Co(NH3)6]2+(2) [Fe(H2O)6]2+(3)[Co(NH3)6]3+
P/cm-122500 17600 21000
△。/cm-111000 1040O 22900
K4[Fe(CN)6]为低自旋配合物,[Fe(H2O)6]Cl3是高自旋配合物。 根据晶体场理论分别写出它们的中心离子的电子排布。
和t2g轨道中的分布,并估计它们的磁矩各约为多少(B.M.).指出这些配合物中何者为商自旋排布,何者为低自旋排布.
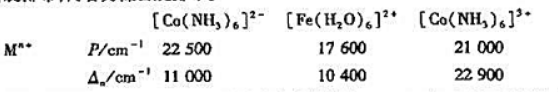
试用价层电子对互斥理论判断下列分子或离子的空间构型(列表写出VP,LP,VP排布,分子构型)。
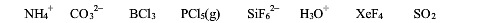
[Co(NH3)6]3+是内轨型配合物,则其中心离子未成对电子数和杂化轨道类型是()。
A.4,sp3d2
B.0,sp3d2
C.4,d2sp3
D.0,d2sp3
已知[Fe(H 2 O) 6 ]] 2+ 的分裂能△ o 为 10400cm -1 ,电子成对能 P 为 17600cm -1 ,可推断该配合物的中心离子 d 轨道排布方式为________,磁矩约为________B.M.,配合物属于________自旋配合物,其晶体场稳定化能为________D q 。
铋及其化合物在工业生产中用途广泛,某研究小组用浮选过的辉铋矿(主要成分是Bi2S3,还含少量SiO2等杂质)制备NaBiO3,其流程如下: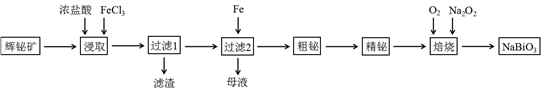 已知:①铋酸钠是一种难溶于水的物质;②水解能力:Bi3+>Fe3+。
已知:①铋酸钠是一种难溶于水的物质;②水解能力:Bi3+>Fe3+。
回答下列问题:
(1)“浸取”时,为了提高浸取速率,可采取的措施有()(任写一条);过滤1的滤渣中的某种主要成分可溶于一种弱酸,写出该反应的化学方程式()。
(2)浸取时加入过量浓盐酸的目的是()。
(3)写出焙烧时生成铋酸钠的化学方程式()。
(4)用H2Dz(双硫腙,二元弱酸)~CCl4络合萃取法可从工业废水中提取金属离子:H2Dz先将金属离子络合成电中性的物质[如Cu(HDz)2等],再用CCl4萃取此络合物。下图是用上述方法处理含有Hg2+、Bi3+、Zn2+的废水时的酸度曲线(E%表示金属离子以络合物形式被萃取分离的百分率)。
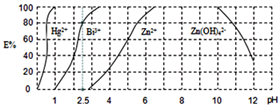 ①当n(Bi3+):n[Bi(HDz)3]=1:4时,废水的pH=()。
①当n(Bi3+):n[Bi(HDz)3]=1:4时,废水的pH=()。
②向萃取后的CCl4中加入足量的NaOH溶液可将Bi(HDz)3中铋元素以氢氧化物的形式沉淀下来,相应的离子方程式为()。
(5)取焙烧得到的NaBiO3样品加入稀硫酸和MnSO4溶液使其完全溶解。已知NaBiO3被还原为Bi3+,Mn2+被氧化成MnO4-,试写出该反应的离子方程式:()。
A.氧离子(O2-)、镁离子(Mg2+)、钠离子(Na+)
B.双氧水(H2O2)、氯化钠(NaCl2)、氯酸钾(KCl)
C.氢气(H2)、氖气(Ne2)、氮气(N2)
D.氧化镁(MgO2)、 二氧化锰(MnO2)、锰酸钾(K2MnO4)
下表是元素周期表中的一部分,回答下列问题: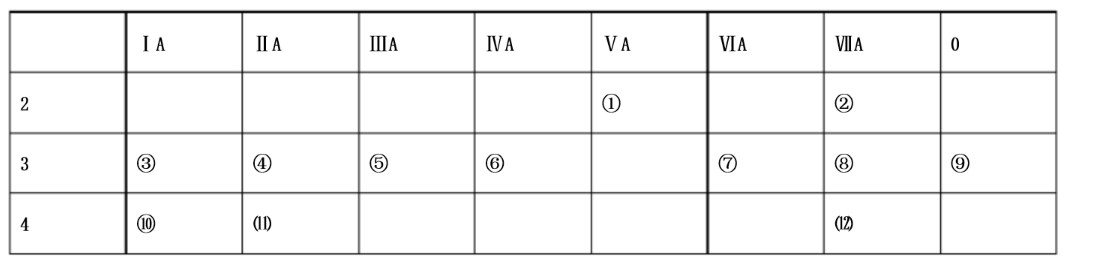 (1)写出下列元素名称①(),⑤(),⑨(),⑾()。
(1)写出下列元素名称①(),⑤(),⑨(),⑾()。
(2)在这些元素中,金属性最强的元素是()﹔除稀有气体元素以外的元素中原子半径最大的是(),原子半径最小的是()。其氢化物最稳定的是()。(填写元素符号)
(3)元素②和③形成的离子的电子层结构()(填“相同”或“不相同”),两者形成的化合物是否是离子化合物()(填“是”或“否”),该化合物的电子式为()。
(4)元素⑧的最高价氧化物对应的水化物化学式为:()名称为()。
(5)在这些元素的最高价氧化物对应的水化物中,属于两性氢氧化物的是()(填写化学式),写出其和盐酸反应的化学方程式()。