 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
某同学用25℃的水溶解一定量的NaCl,充分搅拌后发现杯底还有部分NaCl晶体没有溶解。然后该同学又用酒精灯加热至60C,固体全部溶解。那么在加热前后,以下各量没有发生改变的是()
A.NaCl的溶解度
B.溶质的质量
C.溶剂的质量
D.溶质的质量分数
 答案
答案
C、溶剂的质量
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
A.NaCl的溶解度
B.溶质的质量
C.溶剂的质量
D.溶质的质量分数
 答案
答案
C、溶剂的质量
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“某同学用25℃的水溶解一定量的NaCl,充分搅拌后发现杯底还…”相关的问题
更多“某同学用25℃的水溶解一定量的NaCl,充分搅拌后发现杯底还…”相关的问题
电解工作原理的实际应用非常广泛。
(1)请画出铜棒镀银的简易装置设计图()。(实验可选用品:铜棒,银片,石墨棒,硫酸铜溶液,硝酸银溶液,导线,电源,烧杯)。
(2)工业上为了处理含有Cr2O12-的酸性工业废水,采用下面的处理方法:往工业废水中加入适量NaCl,以铁为电极进行电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成,工业废水中铬元素的含量可低于排放标准。关于上述方法,下列说法错误的是()(填字母)。
A、阳极反应:Fe-2e-=Fe2+
B、阴极反应:2H++2e-=H2↑
C、在电解过程中工业废水由酸性变为碱性
D、可以将铁电极改为石墨电极
(3)某同学设计了如图装置进行以下电化学实验。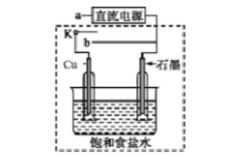 ①当开关K与a连接时,两极均有气泡产生,则阴极为()电极。
①当开关K与a连接时,两极均有气泡产生,则阴极为()电极。
②一段时间后,使开关K与a断开,与b连接时,虚线框内的装置可称为()。请写出此时Cu电极上的电极反应()。
(4)某溶液中含有的离子如下表: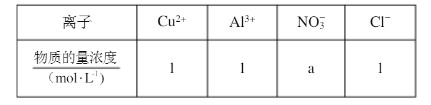 用惰性电极电解该溶液,当电路中有3mole-通过时(忽略电解时溶液体积变化及电极产物可能存在的溶解现象),下列说法正确的是()(填字母)。
用惰性电极电解该溶液,当电路中有3mole-通过时(忽略电解时溶液体积变化及电极产物可能存在的溶解现象),下列说法正确的是()(填字母)。
A、电解后溶液呈酸性
B、a=3
C、阳极生成1.5molCl2
D、阴极析出的金属是铜与铝
过度排放CO2会造成”温室效应“,科学家正在研究如何将CO2转化为可以利用的资源,其中一种方案就是将CO2转化为可再生燃料甲醇(CH3OH)。其化学方程式为: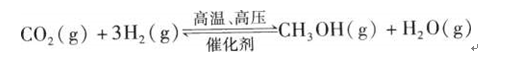
请填空:
问题一、写出上述反应的平衡常数表达式K=()。
问题二、在容积为2L的密闭容器中,用一定量二氧化碳与一定量氢气在一定条件下合成甲醇,实验结果如下图。以下说法正确的选项是()。
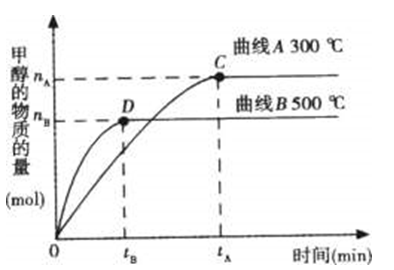
A在300℃,从反应开始到平衡,甲醇的平均反应速率
B反应体系从300℃升温到500℃,平衡常数K变大
C该反应的正反应为放热反应
D处于C点的反应体系从300℃升温到500℃n(H2)/n(CH3OH)增大
问题三、25℃、1.01×105Pa时16g液态甲醇完全燃烧,当恢复至原状态时,放出362.9kJ热量,此反应的热化学方程式为()。
问题四、选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此燃料电池负极应加入或通入的物质是,正极的电极反应式为()。
海洋中蕴含丰富的资源,下图涉及多个以海水为原料的生产流程。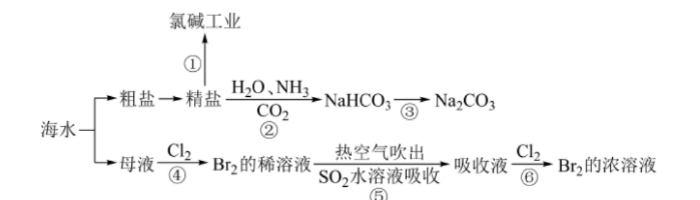 完成下列填空:
完成下列填空:
(1) 步骤①中电解饱和食盐水的化学方程式是()。
(2)工业上用Cl2与KOH(热溶液)制备KClO3,,Cl2+KOH=KCl+KClO3+H2O。配平上述反应方程式,并标出电子转移方向和数目()。
(3)关于卤素的下列说法错误的是()。
A、单质的熔点:Cl2>Br2>I2
B、元素的非金属性:Cl>Br>I
C、单质的氧化性:I2>Br2>Cl2
D、从海洋中获得Cl2,Br2的过程均涉及氧化还原反应
(4)对图中所示生产过程的说法正确的是()。
A、溶解度:NaHCO3>Na2CO3
B、第④⑤⑥步骤中,溴元素均被还原
C、第⑤⑥步骤的目的是进行溴的富集,提高Br2的浓度
D、联碱法与氨碱法相比,NaCl利用率较高,且能耗低
(5)步骤②是在饱和食盐水中先通入NH3再通入CO2,原因是()。
(6)某同学将CO2通入NaOH溶液中,当溶液呈中性时,溶液中浓度最大的微粒是()。
A、c(Na+)B、c(CO32-)C、c(HCO3-)D、c(H+)
A.从C6H12O6一侧向NaCl一侧渗透
B.从NaCl一侧向C6H12O6一侧渗透
C.不存在渗透作用
D.渗透发生,但净结果为0
A.药物在一定量溶剂中溶解的最大的量
B.在一定的温度下,一定量溶剂中所溶解药物最大量
C.在一定的温度下,一定量溶剂中溶解药物的量
D.在一定的压力下,一定量溶剂中所溶解药物最大量
E.在一定的压力下,一定量溶剂中溶解药物的量
随着工业的迅速发展,产生的废水对水体的污染也日趋严重。通过控制溶液的pH对工业废水中的金属离子进行别离是实际工作中经常使用的方法。下表是常温下金属氢氧化物的Ksp(沉淀溶解平衡常数)和金属离子在某浓度下开始沉淀所需的pH(表中浓度为相应pH时溶液中有关金属离子产生沉淀的最小浓度;当溶液中金属离子浓度小于10-5mol•L-1时通常认为该离子沉淀完全)。 问题一、某厂排出的废水中含有Cu2+和Fe3+,测得其浓度均小于0.1mol•L-l。为除去其中的Fe3+,回收铜,需控制的pH范围是()。
问题一、某厂排出的废水中含有Cu2+和Fe3+,测得其浓度均小于0.1mol•L-l。为除去其中的Fe3+,回收铜,需控制的pH范围是()。
问题二、为了处理含有Cr2O72-酸性溶液的工业废水,采用如下方法:向废水中加人适量NaCl,以Fe为电极进行电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成排出,从而使废水中铬含量低于排放标准
①Cr2O72-转变为Cr3+的离子方程式为()。
②pH对废水中Cr2072-去除率的影响如右图。你认为电解过程中溶液的pH取值在()范围内对降低废水中的铬含量最有利,请说明理由:()。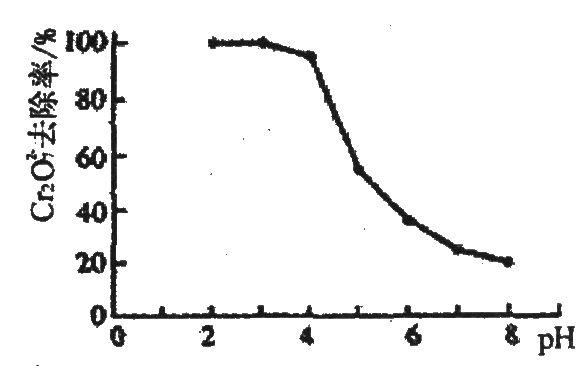
问题三、沉淀转化在生产中也有重要应用。例如,用Na2C03溶液可以将锅炉水垢中的CaS04转化为较疏松而易清除的CaC03,该沉淀转化到达平衡时,其平衡常数K=()。(已知Ksp(CaS04)=9.1x10-6,Ksp(CaC03)=2.8x10-9)